
Phage Technology
Der Zustand der Haut hängt von dem Hautmikrobiom ab. Bakterien wie zum Beispiel Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa oder Streptococcus stören das Gleichgewicht des Mikrobioms und können Hautinfektionen, Entzündungen, Ekzeme und Juckreiz hervorrufen oder verschlimmern.
Mit der Phage Technology haben wir eine innovative Technologie entwickelt, das unter anderem Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa oder Streptococcus zerstört, ohne das restliche Mikrobiom anzugreifen.
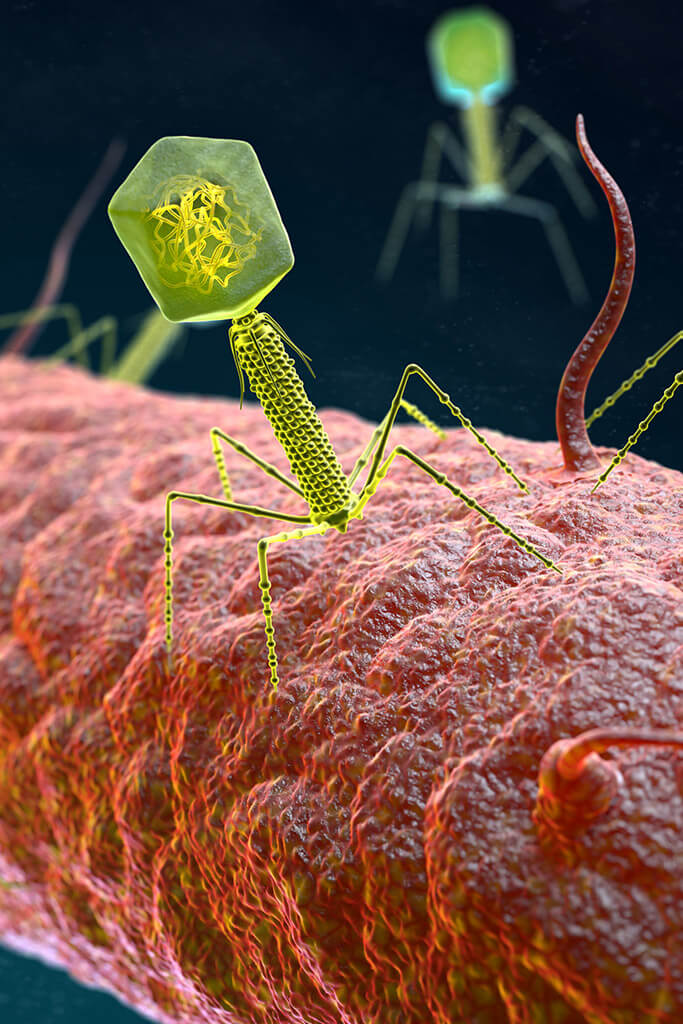
Bakteriophagen
Phagen gewinnen in der modernen Medizin immer mehr an Bedeutung. Nachdem sie durch Antibiotika beinahe in Vergessenheit geraten sind, erleben sie derzeit ein Comeback.
Das hat nicht zuletzt mit dem stetigen Anstieg multiresistenter Keime zu tun. Bakteriophagen stellen in Osteuropa einen schonenden Therapieansatz dar, da sie selbstregulierend wirken, ohne Spuren oder Nebenwirkungen zu hinterlassen.
Eine Phagentherapie ist interessant für Menschen, bei denen der klassische medikamentöse Ansatz nicht mehr hilft. In der EU ist eine medizinische Anwendung nicht zugelassen außer in Belgien. Im Falle von Hauterkrankungen oder zur Stärkung der Hautflora dürfen Bakteriophagen aber extern angewendet werden.
Therapien mit Bakteriophagen werden aktuell allerdings nur in Georgien, Russland und der Ukraine durchgeführt.
Wie das funktioniert, was genau Bakteriophagen sind, wie sie wirken und genutzt werden, erfährst du auf der folgenden Seite.
Was genau sind Bakteriophagen?
Aus dem Griechischen übersetzt heißen Bakteriophagen „Bakterienfresser“. Dieser Name kommt nicht von ungefähr.
Phagen sind Viren, die darauf spezialisiert sind, Bakterienzellen zu zerstören. Bacteriophages, wie sie im Englischen bezeichnet werden, infizieren zuerst die bösartigen Bakterien bevor sie sich dann in ihnen vermehren.
Der dabei ablaufende Prozess ist allerdings um einiges komplizierter als diese kurze Beschreibung vermuten lassen mag.
Bakteriophagen oder kurz genannt auch nur Phagen haben im Prinzip überall dort ihr Einsatzgebiet, wo das passende Bakterium zu finden ist. Sie befallen nur Stämme innerhalb einer Bakterienart, ohne die Artgrenzen zu überschreiten.
Dabei unterliegen Bakteriophagen ebenso wie Bakterien einer ständigen Evolution und entwickeln sich gemeinsam mit diesen weiter.
Dadurch sind sie den Bakterien stets einen Schritt voraus und bleiben wirksam. Im Gegensatz dazu werden die Bakterien zunehmend resistent gegen Antibiotika.
Mit der Zunahme multiresistenter Keime in der Medizin spielen auch Phagen eine zunehmend wichtige Rolle.
Während einerseits keine nennenswerten Nebenwirkungen bekannt sind, dringen einige Phagen auch besser durch Biofilme als pharmazeutisch hergestellte Antibiotika.

Die Geschichte der Phagen
Gemeinhin gilt der in Paris geborene kanadische Biologe und Mikrobiologe Félix Hubert d’Hérelle als Entdecker der Bakteriophagen.
Er war es auch, der den sogenannten „Bakterienfressern” ihren noch heute geltenden Namen gab. Bereits 1919 behandelte er erstmals einen Patienten erfolgreich mit Bakteriophagen.
Heute gehört Georgien mit dem Georgi-Eliava-Institut zu den Vorreitern in der Phagen Technology.
Das Institut ist nach Georgi Eliava benannt. Er pflegte engen Kontakt mit d’Hérelle und gründete im Jahr 1923 die Forschungseinrichtung als bakteriologisches Labor.
In den USA war die Eli Lilly Company bereits in den 1940er-Jahren mit sieben verschiedenen Phagen-Produkten für die Anwendung am Menschen auf dem Markt.
Allerdings waren zur gleichen Zeit die ersten Antibiotika in Europa und den USA verfügbar. Somit wurde die Therapie mit Phagen schnell uninteressant.
Das ändert sich erst jetzt allmählich wieder. Das antibiotische Arsenal verzeichnet kaum noch Neuzugänge und immer mehr Bakterien sind gegen die bisherigen Wirkstoffe resistent.
Zwar steht die Forschung nicht still und es kommen stets neue und wirkungsvollere Medikamente und Therapien auf den Markt.
Gleichzeitig werden aber viele Bakterien zunehmend resistent. Multiresistente Keime sind häufig als „Krankenhauskeime” bekannt und können fatale Auswirkungen auf die Gesundheit eines Patienten haben.
Wie sind Phagen aufgebaut?
Phagen unterscheiden sich je nach Aufbau ihres Genoms und werden in verschiedene Gruppen klassifiziert.
Auch wenn sie sich in Form und Größe erheblich unterscheiden können, gleichen sie sich in der Entstehung mittels Vermehrung. Mangels eines eigenen Stoffwechsels zur Reproduktion, benötigen sie eine geeignete, lebende Bakterienzelle als Wirt.
Die Reproduktion läuft für alle Formen mehr oder weniger gleich ab. Es beginnt mit der Anheftung der Bakteriophagen an die Bakterienoberfläche. Die Phage schleust sein genetisches Material in das Bakterium ein.
Im Inneren des Bakteriums beginnt nun die Produktion neuer Phagen. Sobald die Produktion der neuen Bakteriophagen abgeschlossen ist, löst sich die Hülle des Bakteriums auf (Lyse) und wird somit zerstört. Die unbehüllten freigesetzten Phagen starten einen neuen Prozess.

Welche Phagen unterscheidet man?
Wie bereits erwähnt, gibt es verschiedene Gruppen beziehungsweise Familien von Phagen. Sie werden taxonomisch nach ihrer Morphologie, ihrem Genom und ihrem Wirt eingeteilt.
So unterscheidet man DNA-Phagen mit einzelsträngiger DNA, sogenannte ssDNA-Phagen (von engl. Single-stranded) und solche mit doppelsträngiger DNA, sogenannte dsDNA-Phagen (von engl. double-stranded).
Mittlerweile sind bereits mehr als 6000 verschiedene Bakteriophagen bekannt.
Zum Beispiel gibt es die Temperenten Phagen. Die vermutlich größte Gruppe sind die Caudovirales. Sie sind an ihrem bis zu 230 nm langen Schwanz zu erkennen, der am ikosaedrischen Kopf hängt.
Im Kopf befindet sich das lineare doppelsträngige DNA-Genom. Innerhalb der Caudovirales lassen sich wiederum verschiedene Phagen-Familien einteilen, die leicht unterschiedliche Infektionswege bei den Bakterien einschlagen.
Wie werden Phagen hergestellt?
Phagen bestehen aus Erbmaterial und einer Proteinhülle. Das hat zur Folge, dass sie sich ohne Wirtszelle nicht vermehren können.
Haben sie jedoch eine passende Wirtszelle gefunden, veranlassen sie diesen dazu, das Phagen-Erbmaterial zu vervielfältigen. Nach dem Zerfall beziehungsweise nach dem Platzen des Bakteriums wird das Erbmaterial freizusetzen.
Sie gelten als biologische Waffen gegen Bakterien und als wirkungsvolle Alternative zu Antibiotika. Da Bakteriophagen vielfach einsetzbar sind, werden sie aktuell in verschiedenen klinischen Studien auf ihre Wirksamkeit geprüft.
So hat es sich ein deutsches Forschungsprojekt zum Ziel gesetzt, Bakteriophagen als zugelassenes Arzneimittel gegen bakterielle Infektionen oder Infektionskrankheiten zu etablieren.
„Phage4Cure” wurde von der Berliner Charité initiiert, weil Resistenzen gegen Antibiotika weltweit zunehmen.1
Zu diesem Zweck werden sie ihrem jeweiligen Einsatzgebiet entsprechend im Labor gezüchtet. Im Anschluss werden sie auf Grundlage eines Rezepts der jeweiligen Anwendung entsprechend zu einem Cocktail gemixt.
Dabei unterscheidet man zwischen einem personalisierten Ansatz und einer fixen Rezeptur aus mehreren Phagen.
Vor allem in Krankenhäusern kommt es oft durch multiresistente Keime oder Krankenhauskeime (z.B.: Acinetobacter Baumannii oder Pseudomonas Aeruginosa) zu Komplikationen bei Patienten.
